Version [69676]
Dies ist eine alte Version von TutoriumChemieElektrochemie erstellt von Jorina Lossau am 2016-07-09 10:03:45.
Elektrochemie 1
| File | Last modified | Size |
|---|---|---|
| ChemieElektrochemie.pdf | 2023-10-06 18:37 | 205Kb |
| ChemieElektrochemie1.jpg | 2023-10-06 18:37 | 67Kb |
| ChemieElektrochemie10.jpg | 2023-10-06 18:37 | 68Kb |
| ChemieElektrochemie11.jpg | 2023-10-06 18:37 | 53Kb |
| ChemieElektrochemie12.jpg | 2023-10-06 18:37 | 76Kb |
| ChemieElektrochemie13.jpg | 2023-10-06 18:37 | 2Kb |
| ChemieElektrochemie2.jpg | 2023-10-06 18:37 | 80Kb |
| ChemieElektrochemie3.jpg | 2023-10-06 18:37 | 81Kb |
| ChemieElektrochemie4.jpg | 2023-10-06 18:37 | 72Kb |
| ChemieElektrochemie5.jpg | 2023-10-06 18:37 | 46Kb |
| ChemieElektrochemie6.jpg | 2023-10-06 18:37 | 43Kb |
| ChemieElektrochemie7.jpg | 2023-10-06 18:37 | 66Kb |
| ChemieElektrochemie8.jpg | 2023-10-06 18:37 | 40Kb |
| ChemieElektrochemie9.jpg | 2023-10-06 18:37 | 66Kb |
| Grafik1.jpg | 2023-10-06 18:37 | 38Kb |
| Grafik2.jpg | 2023-10-06 18:37 | 27Kb |
| Grafik3.jpg | 2023-10-06 18:37 | 41Kb |
| Grafik4.jpg | 2023-10-06 18:37 | 49Kb |
| Grafik5.jpg | 2023-10-06 18:37 | 15Kb |
| Grafik6.jpg | 2023-10-06 18:37 | 39Kb |
Grundlagen, wichtige elektrochemische Bauteile
| Grundbegriffe Elektrochemische Reaktionen sind Redoxreaktionen, d.h Reaktionen mit Elektronenübergang. Sie können freiwillig ablaufen (galvanische Zelle) oder durch anlegen einer Spannung erzwungen werden (elektrolytische Zelle). Oxidation: Ist die Teilreaktion bei der Elektronen abgegeben werden. Reduktion: Ist die Teilreaktion bei der Elektronen aufgenommen werden. Anode: Elektrode, an der die Oxidation stattfindet Kathode: Elektrode, an der die Reduktion stattfindet → allgemeingültig, unabhängig von der Art der elektrochemischen Zelle Primärelemente:
Tertiärelement (Brennstoffzelle):
Galvanische Zelle:
Elektrolytische Zelle:
|
| Korrosion von Eisen an feuchter Luft - mehrstufige Reaktion aufgrund der Modifikationen des Eisens-Ions (zwei- und dreiwertig) Oxidation 1: Fe-> Fe^(2+) + 2e^- Anoede(-) RM1 OM1 Reduktion 1: O2 + 4e^- --> 2O^(2-) Kathode(+) OM2 RM2 Folgereaktionen: 2O^(2-) + H2O -->4OH^- Gesamtreaktion: 2Fe + O2 + 2H2O -> 2Fe^(2+) + 4OH^- Ausfällreaktion: 2Fe^(2+) + 4OH -> 2Fe(OH)2 Oxidation 2: Fe^(2+) -> Fe^(3+) + e^- Anode(-) RM1 OM1 Reduktion 2: O2 + 2H2O + 4e^- ->4OH^- Kathode (+) OM2 RM2 Gesamtreaktion: 4Fe^(2+) + O2 + 2H2O -> 4Fe^(3+) + 4OH^- Folgereaktion: 4Fe^(3+) + 12OH^- -> 4Fe(OH)3 Weitere Reaktion bei ausreichender Feuchtigkeit: 2Fe(OH)3 -> 2FeO(OH) + 2H2O -> Fe2O3 + 3H2O |
Zink-Kohle-Batterie (Lechlanche Element)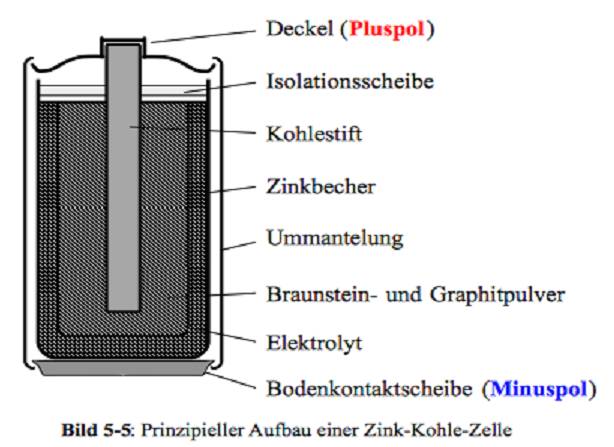 Oxidation: Zn -> Zn2 + 2e^- Anode (-) RM1 OM1 Reduktion: Mn + 4 + e^- -> Mn+3 Kathode (+) OM2 RM2 2MnO2 + 2e^- + H2O -> 2MnOOH + 2OH^- Folgereaktion: Zn2^(+) + 2OH- -> Zn(OH)2 -> ZnO + H20 Alkalinezelle 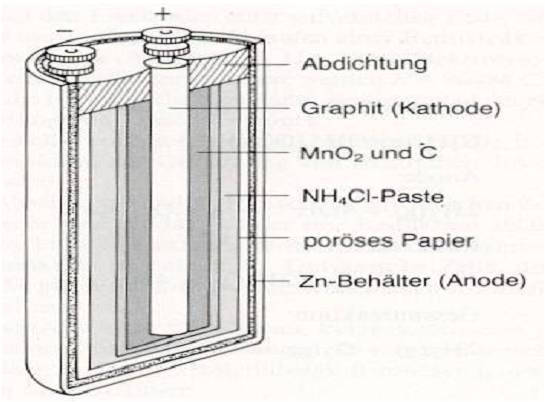 Reaktionen siehe Lechlanche-Element Zink-Luft-Batterie 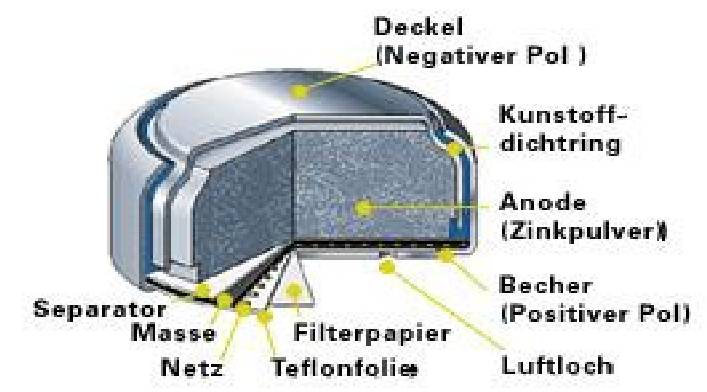 Oxidation: 2Zn -> 2ZN^(2+) + 4e^- Anode(-) RM1 OM1 Reduktion: O2 + 4e^- -> 2O^(2-) Kathode(+) OM2 RM2 Folgereaktion: 2O^(2-) + 2H2O -> 4OH Gesamtreaktion: 2Zn + O2 + 2H2O -> 2Zn(OH)2 oder ZnO + H2O Wasserbrennstoffzelle 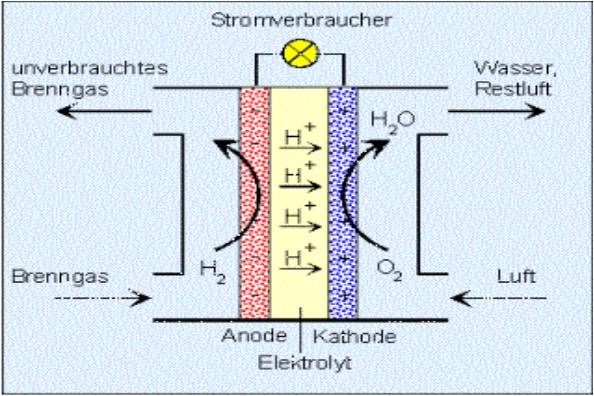 Oxidation: 2H2 -> 4H^(+) + 4e^(-) Anode(-) RM1 OM1 Reduktion: O2 + 4e^(-) -> 2O^(2-) Kathode(+) OM2 RM2 Gesamtreaktion: 2H2 + O2 -> 2H2O Bleiakkumulator (Entladevorgang) 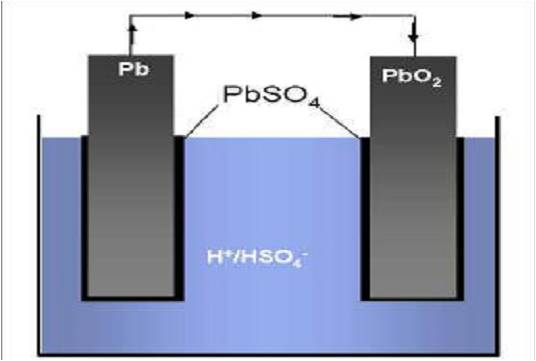 |
| PDF Dokument Elektrochemie |

