Tutorium Chemie
Redoxreaktionen 1- Einführung, Grundbegriffe, Oxidationszahlen
| Definition: Redoxreaktionen sind Reaktionen bei denen Elektronen zwischen den Reaktionspartnern ausgetauscht werden. Sie setzen sich stets aus den Teilreaktionen Oxidation und Reduktion zusammen. Oxidation:Ist die Teilreaktionen bei der Elektronen abgegeben werden. A→A^(+) + e^(-) Reduktion: Ist die Teilreaktionen bei der Elektronen aufgenommen werden. B + e^(-) → B^(-) Oxidationsmittel: Ist der Reaktionspartner der Elektronen aufnimmt (Elektronenakzeptor) und dabei reduziert wird. Reduktionsmittel: Ist der Reaktionspartner der Elektronen abgibt (Elektronendonator) und dabei oxidiert wird. Gesamtreaktion: A→A^(+) + e^(-) Oxidation + B + e^(-)→ B^(-) Reduktion A + B + e^(-)↔AB + e^(-) RM OM Oxidationszahlen: Die Oxidationszahl dient als Hilfsgröße zur Beurteilung von Redoxreaktionen. Manche Elemente haben feste Oxidationszahlen z.B. Sauerstoff und Wasserstoff, die meisten Elemente können jedoch in mehreren Oxidationsstufen vorkommen (siehe Tabelle). Regeln zur Ermittlung von Oxidationszahlen:
Wichtige Ionen im Überblick:
Standard-Redoxpotentiale und elektrochemische Spannungsreihe: -Bezugssystem ist Standard-Wasserstoffelektrode → beliebig auf 0V gesetzt - edle Metalle haben positives Normalpotential, nehmen Elektronen auf - unedle Metalle habe negatives Normalpotential, geben Elektronen ab Beurteilung von Redoxreaktionen: Redoxreaktionen laufen freiwillig ab wenn: - ∆Oz = 0, also die Summe/Differenz aller Ordnungszahlen gleich 0 ist - die Anzahl der ausgetauschten Elektronen gleich ist - E°Red>E°Ox, d.h. Das Normalpotential der Reduktionsreaktion größer ist als das der Oxidation 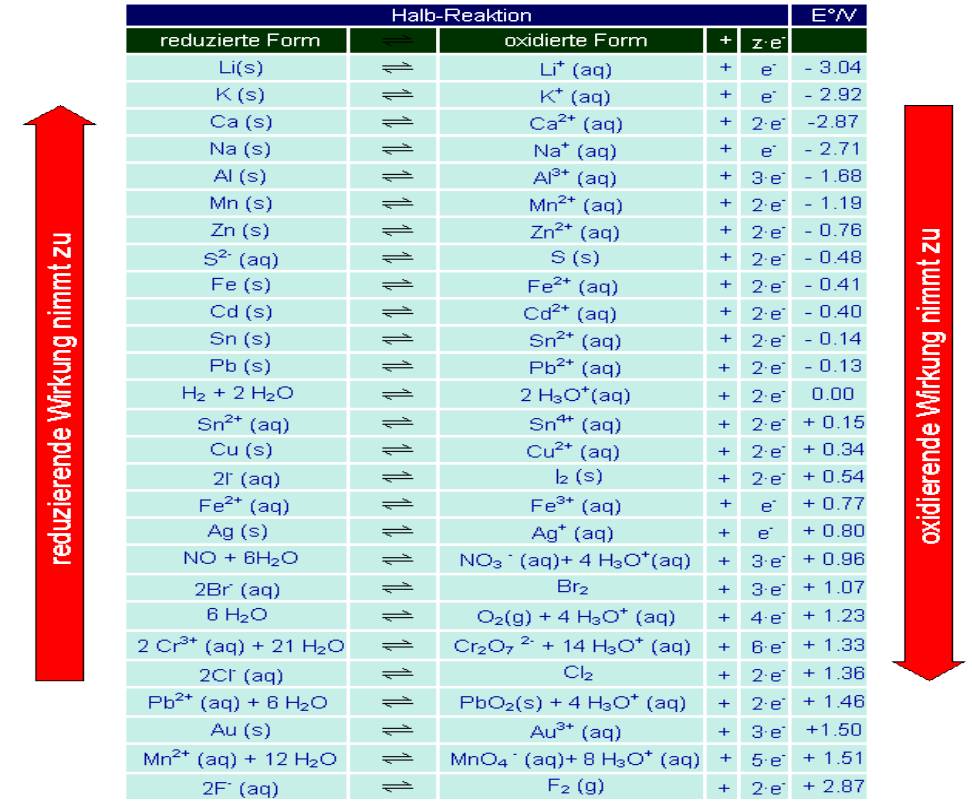 Zusatzaufgaben:
 |

